Advies diagnostiek en profylaxe ter voorkoming van invasieve aspergillose bij volwassen patiënten met influenza, opgenomen op een intensive care afdeling (herziene advies)
LET OP, dit advies is herzien! Klik hier voor het herziene advies
Aanleiding voor dit advies is de waargenomen hoge incidentie (ca. 20%) van invasieve pulmonale infecties veroorzaakt door Aspergillus spp. bij volwassen patiënten opgenomen op de intensive care (IC) met een ernstige influenza infectie in eerdere griepseizoenen. Hoewel er door COVID-19 in de afgelopen 2 seizoenen nauwelijks influenza gevallen zijn opgetreden, is de verwachting dat in het komende seizoen influenza zal terugkeren. Een recent onderzoek (POSA-FLU studie - NCT03378479) geeft aanleiding het SWAB-advies ten aanzien van influenza geassocieerde pulmonale aspergillose (IAPA) van januari 2019 aan te scherpen (zie link).
|
Het POSA-FLU onderzoek betreft een proof-of-concept onderzoek met als doel de waarde van posaconazol profylaxe te onderzoeken bij patiënten die opgenomen werden met ernstige griep op de IC. Er werden 88 patiënten geïncludeerd. Bij 21 patiënten werd de diagnose IAPA gesteld. De IAPA-incidentie van 24% bevestigt de hoge incidentie die werd waargenomen in de eerdere onderzoeken. Als onderdeel van het onderzoeksprotocol dienden patiënten met ernstige griep binnen 48 uur na IC opname diagnostisch onderzoek te ondergaan om de aanwezigheid van IAPA aan te tonen dan wel uit te sluiten. Hieruit bleek dat bij 15 van de 88 (17%) patiënten er bij opname op IC reeds sprake was van IAPA. Met andere woorden, 15 van de 21 (71%) gevallen van IAPA in de studie waren vroege infecties. Ondanks directe antifungale behandeling van deze groep van vroege IAPA gevallen, was de letaliteit 53%. Zes IAPA gevallen werden later tijdens IC opname gediagnosticeerd: twee gevallen in de posaconazol profylaxe groep (beide na het beëindigen van 7 dagen posaconazol profylaxe) en vier gevallen in de controlegroep (tussen dag 2 en 8 post IC opname). Doordat de patiënten met vroege IAPA niet werden geïncludeerd in het onderzoek en er in totaal maar 6 late gevallen van IAPA optraden in de beide studiearmen samen, was er onvoldoende power om een voordeel aan te tonen van posaconazol profylaxe. |
De posaflu-studie bevestigde nogmaals de hoge incidentie van invasieve aspergillose bij patiënten met influenza die op IC behandeld moeten worden, en de associatie van IAPA met een hoge mortaliteit. Mede vanwege deze studie heeft de SWAB aanleiding gezien om het advies ten aanzien van de profylaxe en behandeling van IAPA te reviseren.
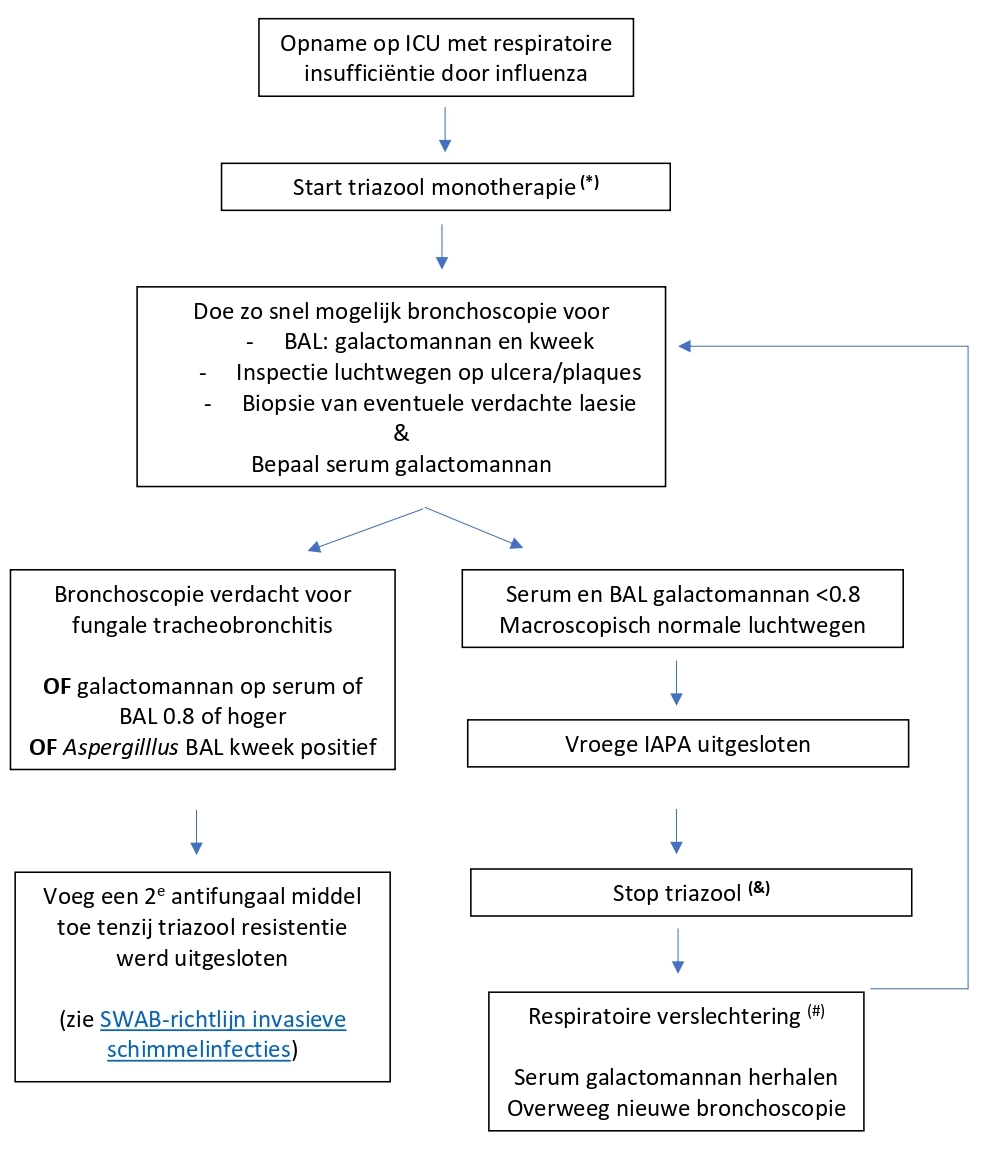
Advies (zie flow chart)
Algemeen
Start bij opname op IC wegens influenza pneumonie empirische antifungale behandeling gericht op invasieve aspergillose met voriconazol, posaconazol of isavuconazol monotherapie. Op basis van een gemiddelde azoolresistentie frequentie in Nederland van ± 10% in combinatie met de a priori kans van 17% op een vroege IAPA, is de a priori kans op azoolresistentie bij vroege IAPA te laag om met combinatietherapie te starten.
In centra waar de resultaten van Aspergillus diagnostiek zeer snel na ICU opname beschikbaar zijn (op dezelfde dag als diagnostiek afname) kan overwogen worden te wachten met het starten van antifungale therapie totdat de eerste uitslagen bekend zijn.
Verricht bij opname op de IC diagnostiek naar invasieve aspergillose waarbij gestreefd moet worden om binnen 48 uur de resultaten beschikbaar te hebben. Om de diagnose IAPA te stellen wordt geadviseerd bronchoscopie en BAL te verrichten en een serummonster af te nemen. Snelle diagnostische testen voor Aspergillus antigeen zijn beschikbaar voor BAL-vloeistof, zoals de lateral flow test (IMMY) en de Virclia Aspergillus galactomannan test, waarbij binnen een uur na ontvangst van het materiaal in het laboratorium een uitslag beschikbaar kunnen zijn (ook in het weekend). Daarnaast worden microscopie en kweek aanbevolen om de diagnose IAPA te stellen.
Bij IAPA-patiënten is veel vaker (50% of meer) dan bij COVID-19 geassocieerde pulmonale aspergillose (CAPA, 10% of minder) circulerend (serum) galactomannan aantoonbaar, met een sensitiviteit die vergelijkbaar is met patiënten met neutropenie. Het wordt derhalve aanbevolen om tevens een serum galactomannan te bepalen.
Indien patiënten met een influenza pneumonie (nog) niet geïntubeerd zijn wordt het verrichten van een bronchoscopie en BAL op basis van klinische haalbaarheid afgewogen. In de meeste gevallen zal dit niet mogelijk zijn. In dat geval wordt aanbevolen om geen profylaxe te starten, maar in elk geval serum galactomannan te bepalen en indien verkregen sputum te onderzoeken middels microscopie en kweek. Het bepalen van Aspergillus antigeen in respiratoir materiaal anders dan in BAL vloeistof wordt niet aangeraden, wellicht ten overvloede dus ook niet op bronchusaspiraat verkregen door “diep uitzuigen” of een non-directed BAL of mini-BAL.
Indien één van de Aspergillus diagnostische testen positief is wordt aanbevolen de infectie te behandelen conform de bestaande SWAB-aanbevelingen. Dat betekent concreet dus een azool in combinatie met een 2e antifungaal middel tot azoolresistentie kan worden uitgesloten.
(*): Indien de dag van opname bronchoscopie gedaan wordt EN de uitslag van BAL-galactomannan binnen 24u bekend is, kan er ook voor gekozen worden te wachten tot galactomannan bekend is.
(&): Met name bij immuungecompromitteerde patiënten kan ook gekozen worden voor profylaxe met een triazool ter preventie van late IAPA.
(#): Klinisch respiratoire verslechtering die plaatsvindt ondanks optimale behandeling van de Influenza pneumonie en zonder duidelijke alternatieve verklaring voor die achteruitgang -zoals atelactase, pleuravocht / empyeem, fibrosering, etc.
Indien de diagnostische testen negatief zijn, zijn er twee opties mogelijk:
• Keuze 1: diagnostisch protocol
Stoppen van empirische antifungale behandeling. Gezien het blijvende risico hierna van ongeveer 10% op IAPA gedurende de IC-opname blijft waakzaamheid geboden en dient laagdrempelig op geleide van het klinisch beloop opnieuw onderzoek naar het optreden van invasieve aspergillose.
• Keuze 2 (alternatief): profylaxe
Stop empirische behandeling, en start (of continueer afhankelijk van de middelen gekozen voor empirische behandeling) voriconazol of posaconazol als profylacticum. Profylaxe wordt met name aanbevolen bij patiënten met onderliggende risicofactoren (zoals beschreven in de EORTC/MSGERC definities), omdat deze groep een hoger risico heeft op IAPA vergeleken met patiënten die deze onderliggende risicofactoren niet hebben. Het advies is om antifungale profylaxe in dat geval te continueren tot herstel van respiratoir falen.
Verricht op geleide van het klinisch beloop (respiratoire verslechtering waarbij andere oorzaken zoals een bacteriële VAP, atelectase en longembolieën uitgesloten kunnen worden) opnieuw diagnostisch onderzoek bij verdenking op een ‘doorbraak' infectie met (azoolresistente) Aspergillus.
NB: Profylaxe wordt niet aanbevolen bij nog niet geïntubeerde en beademde patiënten op de afdeling, medium care of IC.
Invasieve Aspergillus tracheobronchitis
Invasieve Aspergillus tracheobronchitis is een manifestatie van invasieve aspergillose bij ongeveer een derde van de patiënten met IAPA. Hierbij is de infectie gelokaliseerd in de trachea en bronchiën. De sterfte bij IAPA-patiënten met invasieve Aspergillus tracheobronchitis was in een studie 90% (9/10) vergeleken met 44% bij IAPA-patiënten zonder deze manifestatie. De diagnose invasieve Aspergillus tracheobronchitis kan gesteld worden bij bronchoscopie waarbij plaques of ulcera zichtbaar zijn in de trachea en/of grote bronchiën. Als deze afwijkingen zichtbaar zijn dienen biopten afgenomen te worden om de diagnose te stellen. Invasieve Aspergillus tracheobronchitis is vaak slecht zichtbaar op beeldvorming van de long, zoals CT scan.
Bij het vaststellen van invasieve Aspergillus tracheobronchitis wordt aanbevolen met liposomaal amfotericine B te vernevelen in aanvulling op systemische therapie met een azool EN een 2e antifungaal middel in afwachting van gegevens over azool gevoeligheid.
Voor diagnose en behandeling van COVID-19 geassocieerde pulmonale aspergillose (CAPA) wordt verwezen naar het betreffende SWAB-addendum bij de richtlijn [https://swab.nl/exec/file/download/157]. Indien er sprake is van zowel influenza en COVID-19 is het beleid voor IAPA leidend.
Bij het bekend worden van gevoeligheid van relevante respiratoire samples (BAL, biopt) wordt op klinische gronden besloten tot de-escalatie naar monotherapie. Bij onbekende azoolresistentie wordt pragmatisch -bij klinische verbetering- overgestapt naar monotherapie. Totale behandelduur is over het algemeen 4-6 weken en kan in overleg met het klinisch behandelteam worden bijgesteld.
Overwegingen
De korte aanloop tussen het ontstaan van griep klachten en opname op de IC, de hoge IAPA-incidentie en het relatief grote aandeel vroege IAPA gevallen zijn de belangrijkste overwegingen om empirisch antifungale behandeling te adviseren bij alle patiënten die met ernstige influenza op de IC worden opgenomen.
Voor de behandeling van invasieve pulmonale aspergillose beschikken we over drie triazolen die gebruikt kunnen worden voor therapie: isavuconazol, posaconazol en voriconazol. Allen zijn therapeutisch gelijkwaardig aan elkaar. Alle drie de middelen vallen onder de add-on declaratie. Voriconazol en posaconazol zijn als generiek preparaat beschikbaar en derhalve ligt de prijs van deze twee producten beduidend veel lager dan de prijs van isavuconazol. Isavuconazol daarentegen heeft een wat gunstiger bijwerkingenprofiel en, evenals posaconazol, een gunstiger profiel qua interacties met andere middelen ten opzichte van voriconazol.
Voriconazol is geregistreerd voor profylaxe in hoog risico stamceltransplantatie patiënten maar niet voor de algehele IC-populatie. Posaconazol is geregistreerd voor profylaxe in hoog risico hematologische patiënten (AML-MDS, HSCT en GvHD). Profylaxe met beide middelen in de algehele IC-populatie is dus off-label. Isavuconazol heeft geen label indicatie voor profylaxe.
Verneveling van liposomaal amfotericine B is een niet geregistreerde indicatie. Toepassing valt daarom buiten de DWGM (off-label gebruik).
Wijze van toediening
In principe wordt aanbevolen om voriconazol intraveneus toe te dienen i.v.m. kans op malabsorptie bij IC-patiënten. Indien een patiënt kan switchen naar orale therapie (bij goede maag-darm werking), dan wordt de intraveneuze dosering 1 op 1 omgezet naar een orale dosering (afronden op 50 mg).
• Therapeutic drug monitoring (TDM)
Conform de SWAB-richtlijn wordt geadviseerd voor het toepassen van TDM. TDM van voriconazol is sterk aanbevolen, TDM van posaconazol en isavuconazol kan worden overwogen bij IC-patiënten gezien het aanwezig risico op lage blootstelling in deze populatie.
• Geneesmiddeleninteracties
Alle triazolen geven interacties met andere geneesmiddelen. Deze interacties zijn vaak klinisch relevant. De meeste medicatievoorschrijfsystemen in het ziekenhuis voorzien in bewaking van interacties met triazolen en helpen de voorschrijver met een inschatting van de ernst van de interactie. Er zitten noemenswaardige verschillende tussen de drie triazolen qua interactiepotentieel en de mate van invloed op een “victim” geneesmiddel. Neem zo nodig contact op met de ziekenhuisapotheker. Tevens zitten er verschillen in QT-tijd verlenging. Voriconazol en posaconazol zijn beiden QT-tijd verlengend. Isavuconazol leidt tot een QT-tijd verkorting.
• Voriconazol, cyclodextrine en nierfunctie
Er is veel discussie over het gebruik van voriconazol iv. bij patiënten met slechte nierfunctie. Voriconazol oplossing bevat een cyclodextrine (sulfobutylether-β-cyclodextrine). Deze hulpstof stapelt bij slechte nierfunctie maar lijkt zelf niet nefrotoxisch te zijn.
• Verneveling van liposomaal amfotericine B
De optimale dosering voor inhalatie staat nog ter discussie. In de literatuur worden veel verschillende doseringen en concentraties gebruikt alsmede diverse inhalatie duur.
Omwille van potentieel minder bijwerkingen is gekozen voor liposomaal amfotericine B (Ambisome) in plaats van amfotericine B deoxycholaat.
De consensus van de werkgroep (lage evidence) is 3 maal per dag 12 mg Ambisome te geven per inhalatie van minimaal 20 minuten.
De vernevelvloeistof wordt bereid door een vial Ambisome van 50 mg te reconstitueren met 12 mL water voor injecties. Dit levert een eindconcentratie van 4 mg/mL waarvan 3 mL wordt gebruikt voor verneveling.
Literatuur
Invasive aspergillosis in patients admitted to the intensive care unit with severe influenza: a retrospective cohort study. Schauwvlieghe AFAD, Rijnders BJA, Philips N, et al. for the Dutch-Belgian Mycosis study group. Lancet Respir Med. 2018;6:782-92.
Influenza-Associated Aspergillosis in Critically Ill Patient. van de Veerdonk FL, Kolwijck E, Lestrade PP, et al. For the Dutch Mycoses Study Group. Am J Respir Crit Care Med. 2017;196:524-7.
Posaconazole for prevention of invasive pulmonary aspergillosis in critically ill influenza patients (POSA-FLU): a randomised, open-label, proof-of-concept trial. Vanderbeke L, Janssen NAF, Bergmans DCJJ, et al. Dutch-Belgian Mycosis Study Group. Intensive Care Med. 2021;47:674-86.
Invasive tracheobronchial aspergillosis in critically ill patients with severe influenza. A clinical trial. Nyga R, Maizel J, Nseir S, et al. Am J Respir Crit Care Med. 2020;202:708-16.
Birsan T, Taghavi S, and Klepetko W: Treatment of aspergillus- related ulcerative tracheobronchitis in lung transplant recipients. J Heart Lung Transplant 1998;17:437–438. (drie maal daags)
Boots RJ, Paterson DL, Allworth AM, and Faoagali JL: Successful treatment of post-influenza pseudomembranous necrotising bronchial aspergillosis with liposomal amphotericin, inhaled amphotericin B, gamma interferon and GMCSF. Thorax 1999;54:1047–1049. (twee maal daags)
Dal Conte I, Riva G, Obert R, Lucchini A, Bechis G, De Rosa G, and Gioannini P: Tracheobronchial aspergillosis in a patient with AIDS treated with aerosolized amphotericin B combined with itraconazole. Mycoses 1996;39:371–374
Samenstelling advies
- Dr. C.H.S.B. van den Berg, intensivist-infectioloog, Universitair Medisch Centrum Groningen, NVIC/SWAB
- Prof. dr. M.G.J. de Boer, internist-infectioloog, Leids Universitair Medisch Centrum (voorzitter SWAB)
- Dr. R.J.M. Brüggemann, Ziekenhuisapotheker, Radboud UMC
- Prof. dr. B.J.A. Rijnders, internist-infectioloog Erasmus MC
- Dr. J.A. Schouten, internist-intensivist, Radboudumc
- Prof. dr. F. van de Veerdonk, internist-infectioloog, Radboud UMC
- Prof. dr. A.R.H. van Zanten, internist-intensivist, Ziekenhuis Gelderse Valei, NVIC lid
- Prof. dr. P.E. Verweij, arts-microbioloog, Radboud UMC (voorzitter)
|
Wijzigingen: |