Hieronder worden voorbeelden en achtergronden van een aantal thematische verbeterprojecten besproken. In deze tweede druk werden de beste inzendingen van de A-team dag 2017 opgenomen.
In 2016 is het Catharina ziekenhuis Eindhoven begonnen met de inzet van een verpleegkundig specialist ter ondersteuning van het A-team. De verpleegkundig specialist beoordeelt dagelijks de antibioticavoorschriften in het ziekenhuis aan de hand van drie type meldingen die gegenereerd worden door de apotheek:
- Patiënten die 3 dagen hetzelfde antibioticum intraveneus krijgen toegediend (3-dagen regel)
- Patiënten die 7 dagen hetzelfde antibioticum krijgen toegediend (7-dagen regel)
- Patiënten waarbij gestart is met een reserve-antibioticum: meropenem, moxifloxacine, daptomycine, linezolid, anidulafungin, voriconazol. (reserve-regel)
De verpleegkundig specialist bekijkt de informatie in het elektronisch patiënten dossier (reden voor antibioticum gebruik, CRP beloop, temperatuur etc.) en neemt telefonisch contact op met de behandelaar indien er gekozen kan worden voor een alternatief met een smaller werkingsspectrum, of er geswitcht kan worden van intraveneus naar oraal en of een middel gestopt kan worden. Deze aanpak is uitgevoerd op alle afdelingen, behalve op de IC en de kinderafdeling.
Werkzaamheden verpleegkundige:
In de periode januari-december 2016 heeft de verpleegkundig specialist in totaal 2625 meldingen beoordeeld. 1783 meldingen (68%) waren gegenereerd door de 3-dagen regel, 711 meldingen (27%) op basis van de 7-dagen regel en 131 meldingen (5%) vanwege de start van een reserve-antibioticum. Bij 19% van de 3-dagen regel meldingen werd telefonisch contact gezocht (n=334). Na telefonisch contact werd in 49% van de gevallen dezelfde dag of een dag later gestopt met intraveneus antibiotica gebruik. Bij 22% van de meldingen gegenereerd door de 7-dagen regel werd telefonisch contact gezocht (n=159), wat in 32% van de gevallen leidde tot het staken van de antibiotica binnen 1 dag na het telefonisch consult. Het starten van een reserveantibioticum leidde in 27% van de gevallen tot telefonisch contact (n=36). In 42% (n=15) van de gevallen werd het reservemiddel gestopt of omgezet naar een ander middel binnen 1 dag na telefonisch consult. De meeste meldingen en interventies voor de 3- en 7-dagen regels kwamen van de afdelingen interne geneeskunde, longziekten en chirurgie. Reservemiddelen werden met name gestart door longziekten en interne geneeskunde.
Resultaten
Hoewel de telefonische interventies ziekenhuisbreed geen aantoonbare veranderingen teweeg hebben gebracht in het totaal aantal dagen antibioticumgebruik, zijn er lokaal al wel effecten meetbaar. Zo daalde het aantal dagen dat iemand langer dan 7 dagen antibiotica kreeg op de afdeling interne geneeskunde in 2016, ten opzichte van 2014 en 2015. Ook steeg in 2014-2015 bij de interne geneeskunde het gebruik van reservemiddelen, en in 2016 stabiliseerde zich dit. Bij de afdeling longziekten veranderde een stijgende trend in het gebruik van reservemiddelen in 2016 zelfs in een dalende trend, voornamelijk veroorzaakt door verminderd gebruik van Moxifloxacine.
Conclusie
De inzet van een verpleegkundig specialist is een waardevolle kracht in de borging van de continue monitoring van antibioticagebruik. Telefonische interventies en bewustwording dragen bij aan beter antibioticagebruik, waarvan de eerste effecten al binnen 1 jaar zichtbaar zijn.
» Project 2. Clinical rules, audits en interventies
In het Diakonessenhuis in Utrecht vindt er sinds 2012 dagelijks (incl. weekend) controle plaats op antibioticagebruik. Via Clinical Rules komen orders op de werklijst van de ziekenhuisapotheek. Zo’n order wordt beoordeeld, afgehandeld en indien nodig voor overleg doorgezet naar de arts-microbioloog. De volgende Clinical Rules worden gebruikt: reserveantibiotica, langdurig antibioticagebruik (>7 dagen), IV-PO switch (> 3 dagen), verminderde nierfunctie en onlogische combinaties van antibiotica.
Audits
Om te achterhalen wat de kwaliteit van voorschrijven is en of deze verbeterd kan worden, worden er audits uitgevoerd per specialisme. Specialismen waar de meeste antibiotica worden voorgeschreven, komen als eerste aan de beurt, in dit geval interne geneeskunde en chirurgie. Voorafgaand aan de audit wordt gecommuniceerd naar de vakgroep dat er een audit gaat plaatsvinden. De resultaten worden met de vakgroep besproken en verbeteracties worden samen met de vakgroep uitgezet. De uitgevoerde audits zijn gebaseerd op gevalideerde kwaliteitsindicatoren . De kwaliteitsindicatoren zijn onder andere:
voorschrijven volgens lokaal antibioticumbeleid,
- documentatie van de indicatie,
- afname van site- en bloedkweken
- aanpassing naar pathogen directed therapie
- en iv-orale switch binnen 96 uur.
Tijdens de audit worden retrospectief minimaal 50 patiënten geïncludeerd, waarbij eenmalige giften en onderhoudsbehandelingen niet worden meegenomen. Een audit kost ongeveer 4 dagen voor inclusie van 50 patiënten. Dit wordt in het Diakonessenhuis opgedeeld in 1,5 dag voor inclusie patiënten (2 personen), 0,5 dag voor uitwerken data (1 persoon) en 2 uur voor de voorbereiding en bespreking met het betrokken specialisme (2 personen). De structurele investering voor de uitvoering van de Clinical Rules bedraagt voor de apotheek 20 minuten per dag en voor de arts-microbioloog 10 minuten. Daarnaast bespreekt de arts-
microbioloog twee keer per week de antibiotica op de afdeling chirurgie, dit kost per keer 0,5 uur voorbereiden en 0,5 uur bespreken van de patiënten.
Interventies bij chirurgie
Naar aanleiding van de audit op de afdeling chirurgie ligt de focus op iv-orale switch (in 19% van de patiënten wordt voldaan aan de kwaliteitsindicator). Tijdens de audit kwam bijvoorbeeld naar voren dat ceftriaxon en metronidazol vaak langdurig intraveneus (>72 uur) gebruikt worden, terwijl meestal geswitcht kan worden naar amoxicilline-clavulaanzuur per os of gestopt kan worden met antibiotica. Interventies rondom iv-orale switch zijn gestart. Zo zijn er zakkaartjes gemaakt met switch criteria, zijn er twee onderwijssessies gegeven en worden er twee keer per week alle patiënten met antibiotica besproken op de afdeling chirurgie. Daarnaast zijn de Clinical Rules aangepast: voorheen was er alleen toezicht op antibiotica met oraal alternatief en werd bijvoorbeeld ceftriaxon niet meegenomen.
Resultaten interventies chirurgie
Eén jaar na de interventies is er opnieuw een audit uitgevoerd. Hier was een duidelijke verbetering te zien in iv-orale switch binnen 96 uur. De behandelduur van ceftriaxon iv op de afdeling chirurgie is significant gedaald van 5 naar 4 dagen, respectievelijk eerste half jaar van 2016 en eerste half jaar van 2017. Naast iv-orale switch zijn ook het voorschrijven volgens de richtlijn (36% naar 82%) en het aanpassen naar gerichte therapie (33% naar 95%) aanzienlijk verbeterd. Helaas is het niet mogelijk voor de iv-orale switch percentages te vergelijken doordat er verschillende afkapwaard zijn gebruikt (72 uur in audit 2016 en 96 uur in audit 2017).
Conclusie
Het is belangrijk om het specialisme te betrekken bij de audits en interventies. Dit is belangrijk om draagvlak te creëren en samen probleemhouder te zijn. Een audit kost tijd, maar genereert gegevens op basis waarvan onderbouwde interventies kunnen worden uitgevoerd (maximale winst voor afdeling en patiënt) en om, achteraf, vast te stellen of de gekozen interventies nuttig zijn.

» Project 3. Punt Prevalentie Meting
In de Sint Maartenskliniek in Nijmegen is met een puntprevalentie meting (PPM) inzicht verkregen in het voorschrijven en het gebruik van antibiotica door klinische patiënten. Er is daarbij gekeken of dit gebeurt conform het eigen antibioticaboekje en de geldende protocollen en zorgpaden. Op basis van een overzicht van alle patiënten die op de peildatum antibiotica gebruiken, heeft het A-team -bestaande uit twee internist-infectiologen, een medisch micriobioloog en een apotheker- vervolgens de verschillende afdelingen bezocht. Per voorschrift is onder andere nagegaan wat de indicatie was, op welk protocol het voorschrift gebaseerd was en of de dosering correct was.
Resultaten PPM
Van de 112 opgenomen patiënten gebruikten er 51 een antibioticum, 3 patiënten gebruikten 2 antibiotica tegelijkertijd. Op de verpleegafdelingen van de revalidatie ging het om 8 patiënten die antibiotica gebruikten, bij orthopedie om 43 patiënten.
In bijna alle gevallen was het antibioticum voorgeschreven conform het antibioticaboekje en de zorgpaden. Cefazoline werd het meest gebruikt (35 patiënten). De overige voorschriften betroffen voornamelijk ciprofloxacine, co-trimoxazol, clindamycine, vancomycine intraveneus en nitrofurantoïne. Het was voor het A-team geen verrassing dat de belangrijkste indicaties tot het geven van antibiotica ‘chirurgische profylaxe bij een orthopedische operatie’ en ‘de behandeling van infecties aan botten en/of gewrichten’ waren. Er werd 22 maal antibiotica als chirurgische profylaxe voorgeschreven en 11 maal antibiotica op geleide van de kweekuitslag. In 15 gevallen liep het profylactisch gegeven antibioticum door als empirische therapie en werd er verlengde empirische profylaxe gegeven (meer dan 72 24 uur) waarbij er op de voorlopige kweekuitslagen werd gewacht om vervolgens gerichter te kunnen behandelen. Dit waren patiënten bij wie er tevoren rekening werd gehouden met het bestaan van een infectie op het moment van opereren.
Tijdens deze PPM bleek dat cefazoline tweemaal buiten het protocol om werd verlengd naar een langere periode van profylaxe. Een aanvullende analyse liet zien dat dit in het peiljaar 35 keren was voorgevallen (0,8% van het totaal aantal voorschriften cefazoline). Het bleek een specifiek beleid te zijn van de artsen van de orthopedische rug–unit, dat niet was opgenomen in een protocol of zorgpad.
Het A-team ontdekte daarnaast dat niet alle orthopedie patiënten bij wie er peroperatief kweken waren afgenomen, besproken werden op de wekelijkse infectiebespreking, hetgeen niet conform afspraak is. Het was verder opvallend dat het grootste deel van de voorschriften van de afdeling orthopedie werd gebaseerd op de zorgpaden van de verschillende operaties, waarin vaak geen verwijzing naar het antibioticaboekje werd gegeven.
Tenslotte bleek dat er geen eenduidige dosering van nitrofurantoïne als profylaxe werd gebruikt, omdat ons antibioticaboekje hier geen advies over gaf.
Interventies naar aanleiding van PPM
Naar aanleiding van de bevindingen bij bovengenoemde PPS hebben de orthopeden van de rug-unit hun beleid protocollair vastgelegd. Er is duidelijker vastgelegd dat alle patiënten bij wie er peroperatief kweken worden afgenomen, besproken of genoemd moeten worden op de wekelijkse infectiebespreking. Daarnaast zijn alle zorgpaden doorgenomen en er zijn adviezen gegeven om sommige aan te passen en aan te vullen. Momenteel wordt gewerkt aan links naar het antibioticaboekje om het dubbel beschrijven van afspraken te voorkomen. Verder is de dosering van nitrofurantoïne als profylaxe in het antibioticaboekje vastgelegd en gecommuniceerd met de verschillende afdelingen. De effecten van deze maatregelen zijn nog niet achterhaald.
» Project 4. Educatie
Onderwijs vormt een pijler van antibiotic stewardship, maar voor veel A-teams zijn de beschikbare tijd en middelen beperkt. Dit heeft de afgelopen jaren geleid tot een toename in gebruik van e-learning. Hoewel e-learning veel voordelen heeft (flexibel, interactief, bruikbaar voor grote groepen), zijn de beschikbare modules vaak te algemeen, of juist te specifiek. Bovendien is e-learning vaak niet verplicht, en door het individuele karakter vraagt het veel motivatie van de deelnemer. Voor A-teams ligt hierin een belangrijke uitdaging: hoe zorg je ervoor dat mensen een e-learning gaan doen, en hoe zorg je er vervolgens voor dat ze het geleerde ook in praktijk brengen?
Hiertoe werd in het VU ziekenhuis in Amsterdam in 2016 gestart met de ontwikkeling van een e-learning over stewardship en infectiepreventie, gecombineerd met gedragsinterventies die toepassing in de praktijk zouden kunnen bevorderen. Deze e-learning werd specifiek gericht op beginnende aios; zij schrijven een groot deel van antibiotica voor en vormen daarmee een belangrijke doelgroep voor A-teams. In een onderzoek uit 2014 in vier ziekenhuizen in de regio Noord-Holland gaf bovendien 93% van de aios aan meer onderwijs te willen over juist gebruik van antibiotica. Dit onderzoek liet tevens aanwijzingen zien dat face-to-face introductie van e-learning zou kunnen leiden tot meer deelname. Doel van dit project was om met input van de doelgroep een module te ontwikkelen en de optimale timing hiervan vast te stellen. Daarnaast werd de toepassing van gedragsinterventies onderzocht, en de haalbaarheid van implementatie via het introductieprogramma voor nieuwe medewerkers.
Interventies en uitvoering
Een arts-onderzoeker was verantwoordelijk voor ontwikkeling van de e-learning, in samenspraak met internist-infectiologen, medisch microbiologen, onderwijskundigen en webdevelopers. In gedragswetenschappelijke literatuur werd gezocht naar interventies die toepassing in de praktijk zouden kunnen bevorderen. Voor input vanuit de doelgroep werden interviews gehouden met aios uit verschillende specialismen. Samen met onderwijskundigen, psychologen en specialisten werden leerdoelen geformuleerd, als basis voor het ontwerp. Met de afdeling Personeel & Organisatie werd een systeem bedacht om de e-learning tijdens het introductieprogramma onder de aandacht te brengen, en om aios na 3 maanden dienstverband inlogcodes te sturen.
Conclusies
Dit project heeft de volgende inzichten opgeleverd voor de ontwikkeling en implementatie van e-learning door A-teams:
- Aios hebben bij start van hun werkzaamheden behoefte aan onderwijs over antibiotic stewardship en infectiepreventie;
- Er is met name behoefte aan praktische informatie (telefoonnummers, verwijzingen naar swabid/richtlijnen) en oefencasus;
- De eerste 3 maanden in een nieuw ziekenhuis worden door aios als zeer hectisch ervaren, e-learning kan het beste hierna worden aangeboden;
- Het loont om te kiezen voor een module die specifiek gericht is op aios, door zelf een module te ontwikkelen of een bestaande module aan te passen aan de lokale situatie;
- ‘Nudging’, ‘creating a social standard’ en ‘public commitment’ zijn mogelijk nuttige gedragsinterventies om de opbrengst van e-learning te versterken. Aios ervaren deze interventies als acceptabel;
- Het koppelen van e-learning aan het introductieprogramma is een bruikbare manier om aios te bereiken.
» Project 5. Optimaliseren chirurgische profylaxe
Een audit van de chirurgische profylaxe kan een aantrekkelijk project zijn om in de opstartfase van een ASP te doen. Dit omdat het bij chirurgische profylaxe gaat om een relatief eenvoudige handeling (namelijk een eenmalige gift) en omdat de basisprincipes waaraan pre-operatieve antibiotische profylaxe zou moeten voldoen in richtlijnen helder omschreven en wetenschappelijk onderbouwd zijn.Desondanks blijkt dat er in de praktijk nog regelmatig op cruciale punten van de (zeer uitgebreide) richtlijnen wordt afgeweken. De literatuur laat zien dat het belangrijk is om met name het organisatieproces zodanig in te richten dat de kans dat er wordt afgeweken van de richtlijn minimaal is. Het formuleren van duidelijke lokale protocollen is ook hier een essentiële randvoorwaarde, aangezien de internationale richtlijnen door hun uitgebreidheid in de praktijk niet hanteerbaar zijn. Het A-team kan hier een belangrijke rol spelen.
Audit
Tijdens een audit worden de volgende 5 kwaliteitsindicatoren gebruikt bij het meten van de kwaliteit van de chirurgische profylaxe: indicatie, timing, keuze middel, dosis, en duur.
Een duidelijk voorbeeld van een verbeterproject voor het optimaliseren van preoperatieve chirurgische profylaxe in Nederlandse ziekenhuizen is te vinden via onze website. In dit project bleken ineffectieve verspreiding en kennis van lokale protocollen, gebrek aan consensus met de chirurgen over de inhoud van de protocollen en organisatorische factoren op de operatiekamers en afdeling de belangrijkste barrières voor het volgen van de richtlijnen. Met het aanpassen van de lokale richtlijnen, het zorgen voor een betere distributie van en educatie omtrent deze richtlijnen, en faciliteren van de logistiek werd een duidelijke verbetering bereikt van de kwaliteit van de chirurgische profylaxe.
Een leidraad met tips voor het opzetten van een audit en mogelijke interventies is te vinden via onze website.

» Project 6. Begeleiding behandeling S. aureus sepsis
Bij veel patiënten met een S. aureus bacteriëmie (SAB) wordt de diagnostiek en de behandeling niet conform richtlijnen uitgevoerd. Uit een recente studie in een groot Nederlands ziekenhuis bleek dat bij 60% van de patiënten met een SAB geen TEE werd verricht, dat controle bloedkweken op dag 3 slechts bij 6% van de patiënten werden afgenomen, en dat 33% van de patiënten te kort werd behandeld. Een grote Nederlandse studie liet zien dat de mortaliteit onder patiënten met SAB significant lager is na een gecombineerde interventie met consulten aan bed en opsporen van complicaties met TEE en PET-CT scan. Ook internationaal is de meerwaarde van bed-side consulten bij patiënten met SAB goed onderbouwd. Dit is één van de stewardship interventies waar in de meta-analyse van een zeer significant gunstig effect op de mortaliteit werd vastgesteld. Conform de SWAB richtlijn Antimicrobial Stewardship (strong recommendation) heeft de SWAB Werkgroep Antimicrobial Stewardship standaard monitoring en advies alsmede bed-side consult door een infectioloog opgenomen in het stewardship programma. Het ligt daarom voor de hand dit onderwerp op te nemen in de ‘kritische voorschriften’ die in aanmerking komen voor standaard monitoring en advies (hoofdstuk 4). Wanneer het A-team er voor kiest om – naast de standaard monitoring en advies – het beleid bij SAB te optimaliseren als specifiek verbeterproject, dan dient een voor- en nameting te worden verricht om inzicht te krijgen in hoe goed de diagnostiek en behandeling van S. aureus sepsis in het eigen ziekenhuis verloopt en wat de opbrengst van het verbeterproject is.
Hiertoe worden (retrospectief, bijvoorbeeld op basis van gegevens van 1 jaar) de volgende parameters in kaart gebracht:
- Percentage gecompliceerde vs. ongecompliceerde bacteriëmieën (en/of community-acquired vs. hospital-acquired).
- Percentage patiënten bij wie controle bloedkweken werden afgenomen.
- Percentage patiënten bij wie bedside begeleiding door een internist-infectioloog heeft plaatsgevonden.
- Percentage patiënten bij wie een TEE werd verricht.
- Percentage patiënten bij wie een PET-CT scan werd verricht.
- Percentage patiënten bij wie met aanvullend onderzoek complicaties (endocarditis, strooihaarden) werden aangetoond.
- Percentage patiënten met aangepaste behandelduur op basis van aangetoonde complicaties.
- Mortaliteit en/of recidief percentages.
Stel vervolgens vast welke verbeteractie nodig zijn, met aandacht voor onder andere de volgende punten:
- Signaleren van de patiënten met SAB.
- Initieel consult aan bed en advies.
- Follow-up, monitoren van uitkomst van strooihaarden-onderzoek, en advies behandelingsduur.
- Prospectieve meting van bovengenoemde proces- en uitkomstindicatoren.
- Het opnemen van een behandelprotocol in het lokale formularium.
» Project 7. Stroomlijnen
Bij het verbeteren van het voorschrijfgedrag op het gebied van stroomlijnen gaat het vooral om het vinden van die patiënten die in de dagelijkse monitoring ‘onzichtbaar’ zijn, met andere woorden bij wie nog geen deskundige in consult is. Daarnaast moet ook in kaart gebracht worden of er in de dagelijkse monitoring extra aandacht moet worden gegeven aan stroomlijnen bij patiënten die om andere reden al ‘in beeld’ zijn (bijvoorbeeld omdat er een positieve bloedkweek is).
Onder stroomlijnen wordt verstaan het op dag 2 of 3, en vervolgens opnieuw op dag 7, evalueren en zo nodig aanpassen van de antimicrobiële therapie, op basis van klinische gegevens en kweekresultaten. Hierbij kunnen op de volgende beslissingen worden genomen: stoppen, versmallen of gericht switchen naar een ander middel op basis van kweekresultaten, of switchen naar orale toediening. Op dag 7 zal het ook gaan om het vaststellen van de behandelduur, ofwel het voortzetten van de intraveneuze therapie in de thuissituatie.
Het A-team moet vaststellen op welke manier deze ‘onzichtbare’ patiënten kunnen worden geïdentificeerd. Dit kan bijvoorbeeld op basis van behandelduur (bijvoorbeeld langer dan 7 dagen behandeling), of op basis van toedieningsweg (bijvoorbeeld langer dan 72 uur intraveneuze toediening). De ziekenhuisapotheek speelt hierbij een belangrijke rol. Op deze manier kan er ziekenhuisbreed toezicht worden gehouden op het stroomlijnen van antimicrobiële therapie, en kunnen de interventies onderdeel worden van de dagelijkse monitoring van voorschriften van individuele patiënten.
Een vereiste voor optimaal stroomlijnen is het uitvoeren van juiste en tijdige diagnostiek
Dit is een belangrijk punt waarop verbeteracties gericht moeten zijn. De PPM is een goede methode om in kaart te brengen hoe goed de diagnostiek wordt afgenomen bij veelvoorkomende indicaties, bijvoorbeeld thuis-opgelopen pneumonie. Educatie omtrent de juiste methoden van monsterafname, en ‘logistieke’ ondersteuning van de voorschrijver is essentieel. Het beschikbaar maken van informatie via het web-based formularium is een belangrijke randvoorwaarde.
Voorbeelden van interventies die kunnen worden gebruikt om het stroomlijnen structureel te ondersteunen:
- Standaard alerts vanuit apotheek, bijvoorbeeld bij patiënten die langer dan 3 dagen met intraveneuze en/of combinatietherapie worden behandeld, bij patiënten die langer dan 7 dagen antibiotisch behandeld worden, of bij patiënten die behandeld worden met reservemiddelen of ‘beperkt voorschrijfbare middelen’.
- Standaard reminders op de afdeling 72 uur na het starten van antibiotica (kan zo nodig ook middels losse formulieren of stickers op status).
- Educatie gericht op specifieke patiëntcategorieën, bijv. patiënten met een thuis opgelopen pneumonie of urosepsis.
Breng per selectiecriterium in kaart om hoeveel patiënten het dagelijks gaat, om te kunnen beoordelen of het evalueren van de behandeling voor al deze voorschriften in de lokale setting mogelijk zal zijn.
Het switchen van intraveneuze naar orale therapie
Het switchen van intraveneus naar oraal is één van de onderdelen van het stroomlijnen van antimicrobiële therapie. Orale therapie heeft een aantal voordelen boven intraveneuze behandeling:
- Het is makkelijker voor de patiënt (mobiliteit, comfort).
- Het reduceert het risico op flebitis.
- Het gaat gepaard met lagere kosten (m.n. een reductie van de indirecte kosten rondom intraveneuze toediening, zoals verpleegkundigentijd).
- Kan resulteren in een kortere opnameduur.
Bij iedere patiënt die intraveneus wordt behandeld met een middel waarvoor een oraal alternatief beschikbaar is, moet na 48 uur beoordeeld worden of aan de (lokaal vastgestelde) switch criteria wordt voldaan.
Een switchprogramma is vaak één van de eerste interventies die in een ASP worden uitgevoerd. Via het EVS/EPD zijn patiënten relatief makkelijk te identificeren met een klinische beslisregel (te downloaden via onze website), de apotheek speelt hierbij een centrale rol. Met het betrekken van verpleegkundigen in het proces wordt de interventie relatief makkelijk uitvoerbaar.

» Project 8. Dosisoptimalisatie
Dosisoptimalisatie bestaat in grote lijnen uit de volgende 3 interventies:
- Het monitoren van bloedspiegels van bepaalde middelen (vancomycine, aminoglycosiden, colistine, azolen) met het doel toxiciteit te beperken en effectiviteit te maximaliseren.
- Het controleren van doseringen die afwijken van het lokale formularium (de ‘standaard’).
- Het aanpassen van de dosis op basis van individuele patiëntgegevens.
De ziekenhuisapotheker speelt een belangrijke rol bij het identificeren van patiënten bij wie van de ‘standaard’ doseringen wordt afgeweken, bij het uitvoeren van spiegelmetingen, en bij het aanpassen van de dosis op basis van verminderde lever- of nierfunctie. Ook het lokale formularium speelt een belangrijke rol bij dit laatste punt. In dit formularium staan duidelijke aanwijzingen voor de voorschrijver hoe de logistiek omtrent de spiegelcontrole plaatsvindt, en welke acties wanneer door wie moeten worden ondernomen. Voorbeelden van protocollen zijn te vinden via
www.ateams.nl.
» Project 9. OPAT als stewardship interventie
Intraveneuze antibiotica worden in toenemende mate toegediend in de thuissituatie (Outpatient Parenteral Antimicrobial Treatment; ‘OPAT’). Onderzoek heeft laten zien dat patiënten met ernstige infecties (o.a. meningitis, endocarditis, osteomyelitis) of infecties met resistente bacteriën waarvoor geen orale opties voorhanden zijn, veilig kunnen worden behandeld in de thuissituatie. Door OPAT kunnen patiënten in hun eigen vertrouwde omgeving verblijven, wat de kwaliteit van leven ten goede komt. Daarnaast worden potentieel resistente bacteriën op deze manier buiten het ziekenhuis gehouden waardoor de veiligheid van de kwetsbare opgenomen patiënten vergroot wordt. Bovendien is OPAT kostenbesparend. Patiënten komen in aanmerking voor OPAT als hun klinische situatie stabiel is en er een indicatie is voor langdurige intraveneuze antibioticatoediening. Het A-team van het Radboudumc in Nijmegen ondervroeg patienten naar hun ervaringen met OPAT. Patiënten zien het thuis zijn als een groot voordeel en 87% verkiest deze vorm van behandeling dan ook ten opzichte van een verlengde ziekenhuisopname. Vanuit patiëntperspectief is het belangrijk dat er bij de organisatie van OPAT zorg een vast aanspreekpunt is, bijvoorbeeld een gespecialiseerd OPAT-verpleegkundige binnen het ziekenhuis. Vrijheid is waardevol voor OPAT patiënten. Beslissingen over de patiënt dienen dan ook in samenspraak met de patiënt genomen te worden. Daarnaast vindt deze vorm van zorg plaats buiten de veilige omgeving van het ziekenhuis. Zorgverleners dienen zich er bewust van te zijn dat ze te allen tijde er zorg voor moeten dragen dat patiënten zich thuis veilig voelen tijdens OPAT. Dit kan bereikt worden door een uniforme werkwijze, goede informatievoorziening en laagdrempelige toegang tot zorg.
Patiënten vinden het prettig als ze de regie in handen hebben en hun eigen dagindeling kunnen maken. Veel thuiszorgorganisaties houden dan ook rekening met de wensen van de patiënten bij het plannen van hun zorg. De rol van de huisarts verdient hierbij aandacht. Enerzijds worden huisartsen vaak te laat ingelicht door het ziekenhuis, anderzijds geven patiënten aan dat de huisarts te weinig betrokken is bij de antibioticatoediening in de thuissituatie. Op geleide van deze patientervaringen is een vragenlijst ontwikkeld die gebruikt gaat worden om verbeterpunten in de zorg te achterhalen. Deze lijst zal regelmatig opnieuw worden uitgezet om te monitoren hoe OPAT wordt ervaren.
Organisatie van OPAT
Bij de organisatie en begeleiding van deze patiënten wordt geadviseerd om tenminste een infectieziektenspecialist, verpleegkundig specialist en apotheker te betrekken. Een nauwe samenwerking met het transferpunt, medewerkers van specialistische teams van de thuiszorg, huisartsen en de hoofdbehandelaar is hierbij van essentieel belang. Idealiter maakt dit ‘OPAT-team’ deel uit van het A-team. In het Radboudumc is onderstaande organisatiestructuur succesvol gebleken bij de implementatie van een OPAT-team.
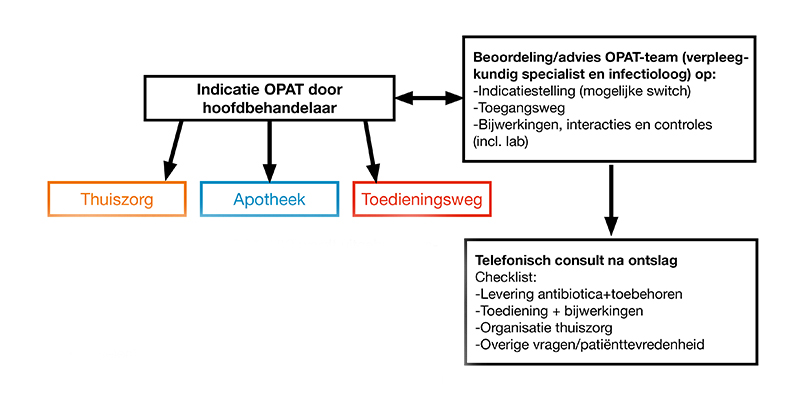
In internationale richtlijnen (IDSA, UK) wordt uitgebreid omschreven hoe de organisatie en implementatie van een OPAT-team dient plaats te vinden.
De hoofdtaken van het OPAT-team zijn:
- indicatiestelling;
- selecteren van de juiste middelen en toegangsweg;
- zorg dragen voor structurele follow-up en deskundig opvangen van complicaties.
Goede informatievoorziening naar patiënten met duidelijke instructies ten aanzien van complicaties (o.a. trombose en lijninfectie) is essentieel. Op het moment zijn er kwaliteitsindicatoren in ontwikkeling die gebruikt kunnen worden om de kwaliteit van OPAT zorg te kunnen bepalen en waar nodig verbeterprojecten in te zetten. Deze kwaliteitsindicatoren en de bovengenoemde patiëntenvragenlijst zullen gebruikt orden om te achterhalen wat de effecten zijn van deze verbeterprojecten.
» Project 10. Gebundelde interventies
In de internationale literatuur is gepleit voor invoeren van antibiotica bundels, vergelijkbaar met de bundels beschreven in de VMS praktijkgidsen. Een bundel is een set van (meestal 3 tot 5) evidence-based handelingen, die wanneer tezamen correct uitgevoerd, resulteren in een gunstiger beloop voor de patiënt. Hierbij geldt er een ‘alles of niets’ benadering; de gelijktijdige naleving van alle bundelonderdelen wordt per patiënt gemeten. Het percentage patiënten bij wie alle bundelonderdelen volgens de norm worden uitgevoerd kan worden gebruikt als procesmaat voor het monitoren van een geïmplementeerde verbeterstrategie. In een ASP zou een bundel een pragmatische benadering kunnen zijn om het voorschrijfgedrag tegelijkertijd op meerdere punten te verbeteren. Een publicatie waarin een voorbeeld wordt beschreven van een ‘antibioticabundel’ is te downloaden via onze website.
» Project 11. De antibiotica checklist
Eerdere studies hebben laten zien dat er ook in Nederland veel ruimte is voor het verbeteren van antibioticagebruik in het ziekenhuis.
De meeste antibiotic stewardship interventies worden georganiseerd vanuit het A-team. Als de artsen die direct verantwoordelijk zijn voor de dagelijkse zorg ook een rol krijgen in het antibiotic stewardship programma kan er mogelijk meer effect bereikt worden.
De
‘antibiotica checklist' is bedoeld als hulpmiddel om de arts te herinneren aan de belangrijkste stappen in antibiotische behandeling in de dagelijkse praktijk. De checklist bestaat uit zeven items, die zijn gebaseerd op gevalideerde kwaliteitsindicatoren, ontwikkeld in een internationale Delphi procedure. Vijf van deze items zijn van toepassing bij aanvang van intraveneuze antibiotische therapie, en twee items zijn van toepassing 48-72uur na start van de therapie (zie bijgevoegde checklist).
De checklist is geïntroduceerd op drie afdelingen van negen Nederlandse ziekenhuizen en in het ziekenhuis op Aruba. Door checklistgebruik verbeterde de kwaliteit van antibioticagebruik significant, welke geassocieerd was met een kortere opnameduur van de patiënt.